티스토리 뷰
LC-MS/MS 기반 약물-단백질 결합 비율(Protein Binding Ratio) 분석 전략– 시료 준비법 비교(Eq. dialysis, ultrafiltration, ultracentrifugation)와 비특이적 결합 억제 기법, 신뢰성 있는 unbound fraction 계산 방법
pharma_info 2025. 8. 12. 23:09
1. 서론 – 왜 약물-단백질 결합 비율 분석이 중요한가?
약물의 단백질 결합 비율(Protein Binding Ratio)은 약리학적 특성과 약동학(PK)에 결정적인 영향을 미치는 요소 중 하나입니다.
혈액 내 대부분의 약물은 albumin, α1-acid glycoprotein(AAG), lipoprotein 등과 가역적으로 결합하며, 결합되지 않은 free(unbound) drug만이 세포막을 투과하거나 약리 작용을 나타낼 수 있습니다.
따라서 단백질 결합 비율이 높으면 자유 약물 농도가 낮아져 약효 발현 속도와 분포 용적(Vd)이 제한되고, 반대로 결합 비율이 낮으면 빠른 작용과 짧은 지속성을 나타낼 수 있습니다.
단백질 결합 분석이 필요한 주요 사례
- 신약 후보물질의 초기 PK profiling
- 병용요법에서의 drug-drug interaction(DDI) 평가
- 간·신장 질환 환자에서 결합 단백질 농도 변화의 영향 분석
- 고단백 결합 약물의 치료 약물 모니터링(TDM)
LC-MS/MS는 이러한 단백질 결합 비율 분석에서 정량 정확도와 선택성을 확보할 수 있는 최적의 기술입니다.
다만, free drug fraction(unbound fraction, fu)을 정확히 구하기 위해서는 시료 준비 단계에서 단백질 제거 및 분획 과정이 매우 중요합니다.
2. 시료 준비법 비교
단백질 결합 분석에서 가장 핵심적인 단계는 free drug와 protein-bound drug의 분리입니다. 대표적인 세 가지 방법을 비교하면 다음과 같습니다.
2.1 Equilibrium Dialysis (ED)
- 원리: 시료(혈장 + 약물)를 반투과성 막으로 구획하여 한쪽에는 시료, 다른 한쪽에는 buffer를 채움 → 시간 경과에 따라 free drug만 막을 통과하여 농도 평형에 도달
- 장점
- 비특이적 결합이 비교적 적음
- 가장 오래되고 표준화된 방법 → FDA, EMA 가이드라인에서 권고
- 단백질 결합이 강한 약물에도 적용 가능
- 단점
- 평형 도달까지 수 시간 이상 필요 → 불안정한 약물에는 부적합
- 낮은 농도 분석 시 free drug loss 가능성
- 실험 시 주의사항
- 온도(37°C)와 pH(physiological range) 유지
- 막 재질 선택(cellulose vs regenerated cellulose) → hydrophobic compound의 흡착 방지
2.2 Ultrafiltration (UF)
- 원리: 원심력으로 단백질이 막 위에 retention되고, free drug는 filtrate로 통과
- 장점
- 신속(수 분 내) → 불안정 약물에도 적합
- 자동화 장비 적용 가능 → HTS(high-throughput screening)에 유리
- 단점
- 막 표면 비특이적 흡착 가능성 큼
- 농도 구배에 따른 단백질-약물 해리 가능성
- 실험 시 주의사항
- 막 재질(PTFE, PES, regenerated cellulose)과 MWCO(molecular weight cut-off) 최적화
- 원심력(g force) 최소화하여 단백질 구조 변화 방지
2.3 Ultracentrifugation (UC)
- 원리: 초고속 원심력으로 단백질과 free drug를 밀도 차이로 분리
- 장점
- 막을 사용하지 않으므로 비특이적 결합이 거의 없음
- 고단백 결합 약물에 적합
- 단점
- 고가 장비 필요
- 장시간 원심분리 → 약물 안정성 문제
- 실험 시 주의사항
- rotor와 튜브 재질 선택(흡착 방지)
- 고속 회전 시 온도 유지(냉각 rotor 사용)
3. 저농도 분석에서 비특이적 결합 억제 기법
저농도 약물 분석에서는 free drug fraction이 막, 튜브, 필터 등의 표면에 흡착되는 비특이적 결합(non-specific binding, NSB) 문제가 발생합니다.
이를 방지하는 전략은 다음과 같습니다.
- Low-binding 재질 사용
- Polypropylene, siliconized tube, LoBind® microtube 등
- 단백질 결합 실험에서 glassware는 지양(특히 lipophilic compound)
- Pre-blocking 처리
- BSA 또는 동일 단백질로 막과 필터를 pre-conditioning
- 예: 0.5% BSA buffer로 필터를 pre-rinse → free drug 흡착 감소
- Surfactant 첨가
- Polysorbate 80, Triton X-100 등 비이온성 계면활성제
- 단, LC-MS/MS 분석 시 이온화 억제 가능성이 있어 농도 최적화 필요
- 온도 및 시간 최소화
- 분석 전 단계에서 sample handling 시간을 줄이고 저온 유지(4°C)
- NSB는 시간과 온도에 비례하여 증가
4. LC-MS/MS 분석 조건 최적화
- 이온화 방식 선택
- ESI(+)는 대부분의 약물에 적합하지만, 고극성/음이온성 약물은 ESI(-) 적용
- Internal Standard(IS) 사용
- Stable isotope-labeled IS → matrix effect 보정과 recovery 계산에 필수
- Calibration curve 설계
- free drug fraction 범위(0.1%~10%까지) 커버 가능한 low-level calibration 필요
5. Unbound fraction 계산
실험에서 얻은 free drug 농도를 이용해 단백질 결합 비율(PB%)과 fu(unbound fraction)을 계산합니다.
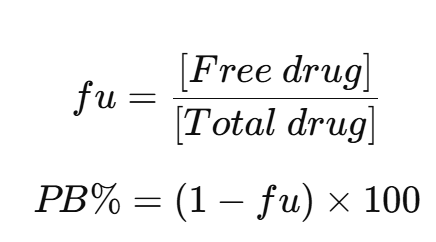
- ED의 경우
- Dialysate 농도와 sample chamber 농도를 이용해 fu 계산
- UF/UC의 경우
- Filtrate 또는 supernatant 농도와 원시 혈장 농도를 비교
중요 포인트
- Recovery 보정 필수: NSB, sample loss, matrix effect로 인한 bias 제거
- QC 샘플에서 fu의 재현성(CV < 15%) 확보
6. 실제 적용 사례
- 고단백 결합 약물(>95%) → Warfarin, Diazepam
- Equilibrium dialysis + LC-MS/MS: 환자별 AAG 농도 변동에 따른 fu 변화 모니터링
- 항암제 → Paclitaxel
- Ultrafiltration 활용 → 병용요법 시 단백질 결합 변화 평가
- 소분자 표적치료제 → Imatinib
- Ultracentrifugation 적용 → long half-life 약물의 안정성 유지
7. 결론
LC-MS/MS 기반의 단백질 결합 분석은 PK/PD 모델링, DDI 평가, 임상용량 설계에서 핵심 데이터로 사용됩니다.
Equilibrium dialysis, ultrafiltration, ultracentrifugation 각각의 장단점을 이해하고, 저농도에서의 비특이적 결합 억제 전략을 병행해야 신뢰성 있는 unbound fraction 데이터를 얻을 수 있습니다.
향후에는 HT-ED(high-throughput equilibrium dialysis)나 microfluidics 기반 UF가 도입되어 분석 효율이 더욱 높아질 것으로 예상됩니다.
'제약산업' 카테고리의 다른 글
| LC-MS/MS 기반 약물-대사체 네트워크 분석을 통한 병태생리 규명 (1) | 2025.08.18 |
|---|---|
| Stable Isotope-Labeled Internal Standard(SIL-IS) 최적화 전략 (3) | 2025.08.16 |
| LC-MS/MS 기반 체외 진단(IVD) 시약 개발과 임상 검증 프로세스 (2) | 2025.08.15 |
| Nano-LC-MS/MS를 활용한 극미량 희귀 질환 치료제 모니터링 플랫폼_ 소량 시료 기반 초고민감 분석법 개발과 환자군 치료 반응성 모니터링 전략 (4) | 2025.08.13 |
| LC-MS/MS 기반 환자 유래 세포 연구(PK/PD 모델링) – ex vivo 시약 노출 스크리닝 전략 (2) | 2025.08.11 |
| 비임상 약물 독성 대사체 스크리닝– LC-MS/MS 기반 Early Toxicity Signal 탐지 전략 (4) | 2025.08.10 |
| Metabolomics 기반 환자 TDM 자동화 예측 플랫폼 구축 전략– 정밀의학을 위한 LC-MS/MS 중심의 데이터 기반 약물 치료 모니터링 체계 (3) | 2025.08.09 |
| Targeted Metabolomics 기반 바이오마커 검증 전략과 통계 결과의 모델링 연계– PK/PD 및 머신러닝 기반 예측 모델 개발을 위한 실무 통합 접근 (4) | 2025.08.08 |
- Total
- Today
- Yesterday
- Spatial metabolomics
- 임상시험
- LC-MS
- 분석팀
- 디지털헬스케어
- 데이터
- 대사체 분석
- 머신러닝
- lc-ms/ms
- metabolomics
- 정밀의료
- 신약 개발
- Multi-omics
- 미래산업
- 약물분석
- 바이오마커
- audit
- 신약개발
- 정량분석
- 분석
- 약물개발
- Targeted Metabolomics
- AI
- 치료제
- matrix effect
- ich m10
- bioanalysis
- 시스템
- 제약산업
- 제약
| 일 | 월 | 화 | 수 | 목 | 금 | 토 |
|---|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 15 | 16 | 17 | 18 | 19 | 20 | 21 |
| 22 | 23 | 24 | 25 | 26 | 27 | 28 |

